Chinone

Chinone (englisch Quinones) sind eine Gruppe organischer Verbindungen, bei denen es sich um gekreuzt-konjugierte zyklische Diketone handelt.[1] Sie sind Oxidationsprodukte von Dihydroxy-aromaten. Die beiden einfachsten Vertreter sind 1,2- und 1,4-Benzochinon, die bei der Oxidation der Dihydroxybenzole Brenzcatechin und Hydrochinon unter Aufhebung der Aromatizität des Ringes entstehen. 1,4-Benzochinon wird mitunter synonym als Chinon bezeichnet.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Der Name Chinon leitet sich von der Chinasäure ab, deren Oxidation u. a. zu 1,4-Benzochinon führt. Bei der Nomenklatur der Chinone geht man vom aromatischen Stammskelett aus (Benzo-, Naphtho-, Anthra- etc.), stellt die Positionen der beiden chinoiden Carbonylgruppen im Molekül voran (z. B. 1,2-, 1,4-) und endet mit „chinon“ (Beispiele: 1,4-Benzochinon, 1,2-Naphthochinon, 9,10-Anthrachinon).[1] Verbindungen, deren chemische Struktur ein Chinon-Element enthält, nennt man chinoid, das Strukturelement selbst chinoides System. Die Reduktion von Chinonen liefert die zugehörigen Hydroxyaromaten, die auch Chinole genannt werden.
Die durchweg farbigen Chinone sind Oxidationsmittel, deren Redoxpotential durch Substituenten (Halogen-, Cyano-, Alkyl-, Hydroxy-Gruppen etc.) deutlich verändert wird. Man unterscheidet zwischen 1,2-(ortho-)Chinonen (z. B. Pyrrolochinolinchinon) und 1,4-(para-)Chinonen (z. B. Anthrachinon).
Formaler Ersatz des Sauerstoffs einer chinoiden Carbonyl-Gruppe durch =NH, =NOH, =N2 oder =CH2 führt zu Chinoniminen, Chinonoximen, Chinondiaziden und Chinonmethiden.
Unter den Chinonen finden sich viele Gifte, aber auch ein breites Spektrum lebensnotwendiger Vitalstoffe, z. B. Ubichinon-10 (Coenzym Q10), Vitamin K und Pyrrolochinolinchinon.
Der Grundkörper Chinon wurde zuerst 1838 von dem russischen Liebig-Schüler Alexander Abramowitsch Woskressenski synthetisiert.[2]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
In der Natur kommen Chinone besonders häufig in Farbstoffen vor, z. B. in Pilzen, Bakterien oder Blüten. Chinoide Systeme findet man auch in verschiedenen Antibiotika. Unter anderem entstehen Chinone durch enzymatische Oxidation von Polyphenolen. So spielen sie beispielsweise bei der Braunfärbung angeschnittener Äpfel eine wichtige Rolle.
Bekannte Chinone sind:
- Adrenochrom, Dopachrom, Echinochrom A
- Bovichinone, orangerote Farbstoffe in Pilzen
- Dichlordicyanochinon (DDQ)
- Hydroxynaphthochinone, z. B. in Henna und Walnüssen
- Plastochinone und Phyllochinone bei der Photosynthese
- Pyrrolochinolinchinon (PQQ)
- Tryptophantryptophylchinon (TQQ)
- Ubichinone als Elektronenüberträger in der Atmungskette
- K-Vitamine (Phyllochinon, Menachinon)
Chinone werden auch in den Wehrsekreten von Insekten gefunden, vor allem Benzo- und Toluchinone.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Chinone bilden sich u. a. durch Oxidation von Phenolen oder polycyclischen aromatischen Kohlenwasserstoffen. Dabei erweisen sich besonders Cer(IV)-Verbindungen wie Ammoniumcer(IV)-nitrat als nützlich.
Redoxaktive und reaktive o-Chinone lassen sich durch die Umsetzung von trans-Dihydrodiolen mithilfe des Enzyms AKR1A1 biosynthetisch herstellen.[3]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Synthetisch wichtig sind die (gegebenenfalls photochemisch ausgelösten) Cycloadditions-Reaktionen der Chinone, die zu Cyclobutan-Derivaten, Oxetanen, Käfigverbindungen und Pyranen führen können. Olefine addieren sich z. B. bei Belichtung an das 1,2-Dicarbonyl-System von ortho-Chinonen, das in diesen Fällen als Hetero-1,3-dien-System fungiert (siehe Diels-Alder-Reaktion). Dies geschieht unter anderem unter Bildung von Dioxan-Derivaten (Schönberg-Reaktion).
Das im Gegensatz zu den Reinsubstanzen tieffarbige 1:1-Gemisch von 1,4-Hydrochinon und 1,4-Benzochinon nennt man Chinhydron, ein klassisches Beispiel für einen Charge-Transfer-Komplex.
Semichinone
[Bearbeiten | Quelltext bearbeiten]Die Reduktion von Chinonen zu Chinolen geschieht, wie hier am Beispiel des 1,4-Benzochinons gezeigt, mehrstufig über reaktive radikalische Zwischenverbindungen, die Semichinone.
Dabei sind die Reduktionsvorgänge mit Säure-Basen-Gleichgewichte gekoppelt.[4] Diese sind z. T. recht beständig, wie die Semichinone der Ubichinone. Die Reduktion des Chinons mit der Bildung eines Semichinons und dessen weiterführende Reduktion zum Hydrochinon sei nochmal näher am Beispiel von 1,4-Benzochinon erläutert:
Aus dem 1,4-Benzochinon 1 entsteht nach Protonierung und Reduktion das Semichinon 2. Das ungepaarte Elektron ist dabei, wie aus seiner und den drei Mesomerie-Formeln unter ihm zu sehen, über das gesamte semichinoide System delokalisiert. Die weitere Reduktion nebst Protonierung führt dann schließlich zum Hydrochinon 3.
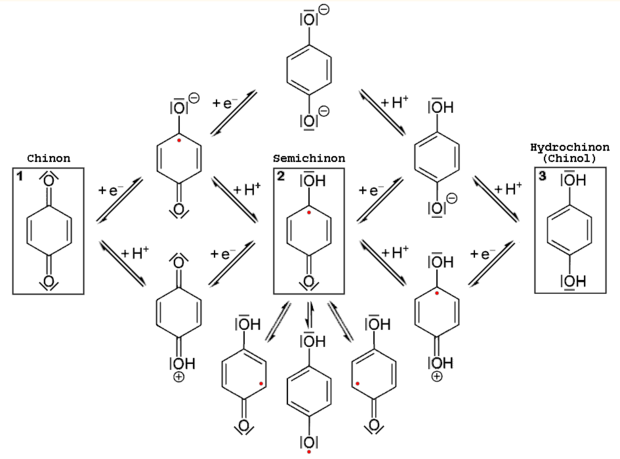
Redoxgleichgewichte (l.u. nach r.o.) sowie Säure-Basen-Gleichgewichte (l.o. nach r.u.) für Chinon am Beispiel von 1,4-Benzochinon. Redoxgleichgewichte (l.u. nach r.o.) sowie Säure-Basen-Gleichgewichte (l.o. nach r.u.) für Chinon
am Beispiel von 1,4-Benzochinon.[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Chinone finden als Oxidationsmittel, Bakterizide und analytische Reagenzien Verwendung. Sie entstehen auch als Zwischenprodukt bei Farbstoffsynthesen (siehe auch Alizarin). Auch in Malariamedikamenten spielen Chinone eine wichtige Rolle. In der technischen Chemie sind sie vor allem zur Gewinnung von Wasserstoffperoxid über Anthrachinon wichtig.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 355 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Winfried R. Pötsch, Annelore Fischer und Wolfgang Müller unter Mitarbeit von Heinz Cassebaum: Lexikon bedeutender Chemiker, VEB Bibliographisches Institut Leipzig, 1988, ISBN 3-323-00185-0, S. 441.
- ↑ Nisha T. Palackal, Michael E. Burczynski, Ronald G. Harvey, Trevor M. Penning: The Ubiquitous Aldehyde Reductase (AKR1A1) Oxidizes Proximate Carcinogen trans-Dihydrodiols to o-Quinones: Potential Role in Polycyclic Aromatic Hydrocarbon Activation. In: Biochemistry. Band 40, 2001, S. 10901, doi:10.1021/bi010872t.
- ↑ L. Michaelis, M. P. Schubert: The Theory of Reversible Two-step Oxidation Involving Free Radicals. In: Chem. Rev. 22 (3), 1938, S. 437–470; doi:10.1021/cr60073a003.
- ↑ nach Paul Rys, Heinrich Zollinger: Farbstoffchemie. Ein Leitfaden. 3., neubearb. Auflage. Wiley-VCH, 1982, ISBN 3-527-25964-3, S. 45.

